A termodinâmica estuda as relações entre o calor trocado e o trabalho realizado num processo físico, que envolve uma massa de gás e o meio externo, ou seja, o meio ambiente.
Primeira Lei da Termodinâmica
Também chamado de primeiro princípio da termodinâmica, essa lei é conhecida como o Princípio da Conservação da Energia. Para todo e qualquer sistema termodinâmico há uma função característica, que é conhecida como energia interna. Sabendo disso podemos enunciar essa primeira lei da seguinte maneira: a variação da energia interna entre dois sistemas pode ser determinada pela diferença entre a quantidade de calor e o trabalho trocado com o meio ambiente. Matematicamente essa lei pode ser escrita da seguinte forma:
Primeira Lei da Termodinâmica
Também chamado de primeiro princípio da termodinâmica, essa lei é conhecida como o Princípio da Conservação da Energia. Para todo e qualquer sistema termodinâmico há uma função característica, que é conhecida como energia interna. Sabendo disso podemos enunciar essa primeira lei da seguinte maneira: a variação da energia interna entre dois sistemas pode ser determinada pela diferença entre a quantidade de calor e o trabalho trocado com o meio ambiente. Matematicamente essa lei pode ser escrita da seguinte forma:
ΔU = Q – T
Onde:
- Q é a quantidade de calor recebida ou cedida;
- T é o trabalho realizado pelo sistema ou que é realizado sobre o mesmo;
- ΔU é a variação da energia interna do sistema.
Essa lei tem aplicação prática em três transformações particulares de um gás perfeito. Lembrando que um gás perfeito ou ideal é um modelo idealizado para o comportamento de um gás, o qual obedece às leis de Gay Lussac, lei de Boyle Mariotte e a lei de Charles.
Carla Garcia - 1002







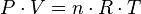
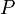 = Pressão
= Pressão = Volume
= Volume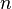 = Moles de gás.
= Moles de gás.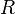 =
= 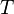 = Temperatura em Kelvin.
= Temperatura em Kelvin.
 e
e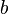 são constantes determinadas pela natureza do gás com o fim de que haja a maior congruência possível entre a equação dos gases reais e o comportamento observado experimentalmente.
são constantes determinadas pela natureza do gás com o fim de que haja a maior congruência possível entre a equação dos gases reais e o comportamento observado experimentalmente.