Empiricamente, observam-se uma série de relações entre a temperatura, a pressão e o volume que dão lugar à lei dos gases ideais, deduzida pela primeira vez por Émile Clapeyron, em 1834.
A equação de estado
A equação que descreve normalmente a relação entre a pressão, e volume, a temperatura e a quantidade (em moles) de um gás ideal é: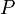 = Pressão
= Pressão = Volume
= Volume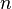 = Moles de gás.
= Moles de gás.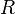 = Constante universal dos gases perfeitos
= Constante universal dos gases perfeitos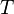 = Temperatura em Kelvin.
= Temperatura em Kelvin.
A equação de estado para gases reais
Tomando em conta as forças intermoleculares e volumes intermoleculares finitos, obtem-se a equação para gases reais, também chamada equação de Van der Waals: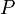 = Pressão do gás ideal
= Pressão do gás ideal = Volume do gás ideal
= Volume do gás ideal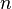 = Mols de gás
= Mols de gás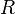 = Constante universal dos gases perfeitos
= Constante universal dos gases perfeitos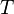 = Temperatura
= Temperatura e
e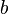 são constantes determinadas pela natureza do gás com o fim de que haja a maior congruência possível entre a equação dos gases reais e o comportamento observado experimentalmente.
são constantes determinadas pela natureza do gás com o fim de que haja a maior congruência possível entre a equação dos gases reais e o comportamento observado experimentalmente.
Postado por :Milla e Nathalia e Thaís Neves
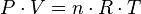

Ótimo trabalho, meninas!! Beijos, Marisa
ResponderExcluir