QUÍMICA
Ligação iônica é um tipo de ligação química baseada na atração eletrostática entre dois íons carregados com cargas opostas. Na formação da ligação iônica, um metal doa um elétron, devido a sua baixa eletronegatividade formando um íon positivo ou cátion. No sal de cozinha, as ligações entre os íons sódio e cloreto são iônicas. Geralmente ligações iônicas se formam entre um metal e um ametal. O átomo do ametal tem uma configuração eltetrônica semelhante a de um gás nobre,
quase totalmente preenchida de elétrons. Eles têm alta
eletronegatividade, e facilmente ganham elétrons formando um íon
negativo ou ânion. Os dois ou mais íons logo se atraem devido a forças eletrostática. Ligações desse tipo são mais fortes que ligações de hidrogênio, e têm força menor que as ligações covalentes.
A ligação iônica ocorre somente se a variação da energia total da
reação é favorável—quando os átomos ligados tem energia mais baixa que
os átomos livres. Quanto maior a variação da energia total, mais forte
se torna a ligação.
Estudos revelaram que não existe ligação iônica pura. Todas ligações iônicas tem um grau de ligação covalente ou ligação metálica. Quanto maior a diferença na eletronegatividade entre dois átomos mais iônica se torna a ligação. Compostos iônicos conduzem eletricidade quando fundidos ou em solução. Eles geralmente tem um alto ponto de fusão e tendem a ser solúveis em água.
Ligação eletrônica e ligação estrutural :

Representação de Lewis, onde dentro da ogiva consta um par de elétrons compartilhado:
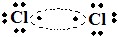
Veja as fórmulas estrutural e molecular abaixo, respectivamente:
Cl─Cl e Cl2
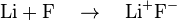


Nenhum comentário:
Postar um comentário